文獻標識碼: A
文章編號: 0258-7998(2014)06-0070-04
癌細胞分選儀是對細胞樣品進行癌細胞檢測、計數、分選以及分析的裝置。現代基于流式細胞術的流式細胞分選儀或分析儀通過激光激發熒光的方式[1],檢測細胞的熒光和散射光來獲取細胞的參數,并通過分析參數對細胞進行計數或分選等操作。這種方式具有檢測精度高、分析速度快、分選率高等優點,得到了廣泛的應用[2]。
傳統的細胞分選儀大多是基于石英管和毛細管等平臺,具有集成度比較低、耗費樣品量大的缺點[3]。新興的微流控芯片通過微機電技術(MEMS),將細胞處理、檢測與分選等操作集中在一塊芯片上,大大提高了集成度,并且耗費樣品低,是一種應用前景廣闊的技術[4]。本文在微流控芯片的平臺上,設計了癌細胞分選儀的硬件系統,完成了癌細胞熒光檢測電路與用于微流控芯片內細胞分選的高壓脈沖源設計,實現了在微流控芯片上癌細胞檢測、計數以及分選的結合。
1 系統結構
整個儀器包括液滴產生系統、微流控平臺與激發光路、主控電路、熒光檢測電路、高壓脈沖源和細胞分選系統。系統的結構如圖1所示。
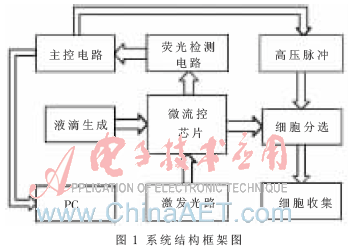
液滴生成系統通過恒流泵在微流控芯片內通過流體聚焦將細胞包裹在液滴中并且在芯片溝道中快速流動,激光器(532 nm)發出的激光經過光路聚焦到芯片溝道一個點上,對癌細胞進行熒光激發。
使用北京濱松公司生產的電流輸出側窗型光電倍增管(PMT)進行熒光檢測[5],將光信號轉換為微弱負電流信號,然后通過熒光檢測電路的放大、濾波、A/D轉換傳送到主控電路,主控電路對信號進行分析并判斷是否讓高壓系統產生高壓脈沖進行細胞分選。
系統主控電路采用Atmel公司的Atmega128芯片作為主控芯片,完成與PC通信、采集與處理熒光數據、高壓分選系統等功能。
微流控平臺示意圖如圖2所示。整個微流控芯片包括進樣口、液滴產生溝道(圖中未畫出)、主溝道、正負電極、分選溝道等部分。電極做在溝道兩側并與溝道處于同一高度,以產生垂直于溝道的均勻電場。

圖2微流控芯片示意圖
2 熒光檢測電路設計
熒光檢測電路用于檢測PMT輸出的微弱負電流信號。癌細胞產生的熒光信號比較微弱,PMT輸出的負電流范圍為數百皮安~數微安。這要求前置放大電路具有低噪聲、高精度的特性[6]。整個熒光檢測電路包括前置變阻放大、濾波電路、DAC電路。
前置放大電路采用變阻放大的電路結構,如圖3所示。電路的直流增益倍數取決于反饋電阻R2,根據Vout=Iin·R2可以計算前置電路輸出電壓。由相關文獻可知[7],采用一級放大可以獲得最高的信噪比。為了避免輸入屏蔽電纜的寄生電容[8]引起電路振蕩,在電路設計中加入電容C1,用以補償信號的相位。反饋電阻R2并聯合適的反饋電容C2,限制信號的帶寬。R3和C3在信號回路中形成一個低通濾波器,抑制由于背景光引起的噪聲和電阻R2的熱噪聲,同時避免了產生很大的負載效應[9]。
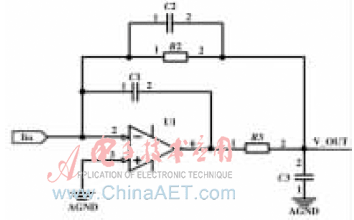
圖3 前置放大電路
由于要檢測微弱的負電流信號,所以對于運算放大器U1有較高的要求。運放應當具備極小的輸入偏置電流、噪聲低和較大帶寬增益積的特性。綜合以上考慮,設計中選擇了美國Linear公司的CMOS輸入型精密運放LTC6240HV,該運放的性能參數有:(1)0.1 Hz~10 Hz噪聲為550 n Vp-p;(2)輸入偏置電流IB:典型為0.2 pA,最大為1 pA;(3)帶寬增益積:18 MHz。在實際的電路測試中,該運放對弱電路的檢測能力滿足系統對檢測精度的要求。
3 可調高壓脈沖源設計
設計的高壓脈沖源用于產生0~1 200 V范圍的可變寬度的脈沖信號,形成垂直電場加在微流控芯片的溝道兩側,以分選檢測到的癌細胞液滴。分選時通過調節脈沖的寬度和高度來達到最優的分選效果。
可調高壓脈沖發生器的結構如圖4所示,整個電路包括了可調直流高壓模塊,DAC高壓調節電路、IGBT以及IGBT驅動電路等部分。電路采用兩個IGBT組成半橋結構,采用懸浮驅動技術[10],避免了采用單個IGBT時由于負載太輕而導致關斷時放電太慢,形成下降沿不夠陡峭的問題。通過單片機的控制信號控制IGBT驅動器,從而控制上下兩個IGBT的導通與關斷,形成脈沖寬度可調的脈沖信號。單片機控制DAC輸出不同電平的高壓調節信號控制高壓模塊,來獲得0~1 200 V范圍內的脈沖峰值。系統中采用的直流高壓模塊為恒博可調高壓,輸出電壓為0~1 200 V,IGBT為FGA25N120ANTD,耐壓值為1 200 V, IGBT驅動器采用exb841模塊。
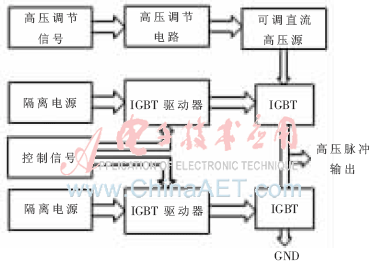
圖4 可調高壓脈沖源結構框圖
在電路測試中發現,IGBT切換產生脈沖時,會產生比較大的電壓尖峰,當設置的電壓較高時,產生的電壓尖峰很可能會對電路元件產生損壞,因此在電路中加入了尖峰吸收與緩沖電路,如圖5所示。

圖5 尖峰吸收與緩沖電路
電路中D2與D3構成雙向限幅電路,將驅動電壓限制在-5 V~+15 V,R5與C8組成RC電路設定脈沖上升與下降時間,以消除電壓尖峰,RC時間常數越大,消除尖峰效果越好,但同時脈沖上升與下降時間變長,測試中發現R5取10 Ω,C8取20 pF時,可以獲得比較良好的消峰與脈沖邊沿特性。D1與C7用于保護exb841內部的穩壓管。
4 系統測試
4.1熒光檢測電路測量精度測試
直流信號下,檢測電路輸出的結果與五位半萬用表測量結果相比,偏差小于50 μV。
在電路懸空輸入(輸入電流為零)情況下測試電路噪聲與分辨力,當采樣率為10 Hz時,得到的輸出噪聲曲線如圖6所示。可以看到在此采樣率下電路本身噪聲Vp-p小于5 μV,根據反饋電阻為100 kΩ,等效輸入電流噪聲為50 pA,可認為電路具有100 pA量級的輸入電流信號分辨能力,滿足系統的測量要求。采樣率上升時,ADC引起的噪聲會有所增加。

圖6 電路噪聲測試
采用檢測電路檢測濃度為8×104/mL的乳腺癌細胞熒光曲線如圖7所示。細胞懸浮液中的雜質會引起一些較低的峰,使用無癌細胞的懸浮液進行對比發現,雜質引起的峰一般小于400 mV,可以通過設定這個電壓作為閾值來判斷檢測到的峰是否是細胞引起的。從圖中可以看到,5 s內檢測到了6個癌細胞。
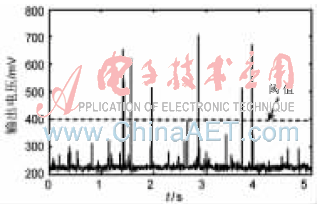
圖7 癌細胞熒光檢測結果
4.2 高壓脈沖信號源測試
經過單片機軟件的線性偏差修正后,高壓脈沖的峰值與預設值之間偏差小于1 V,具有較高的精度,滿足系統的要求。
脈沖的上升時間和下降時間可以通過IGBT的基極串聯電阻來調節,以取得脈沖過沖尖峰大小和上升、下降時間大小的平衡,在本設計中取基極串聯電阻為10 ?贅,得到的1 200 V左右時脈沖上升下降波形如圖8所示。可以看到脈沖上升、下降時間都約為10 μs,脈沖源最高可以產生頻率為20 kHz的高壓脈沖信號。
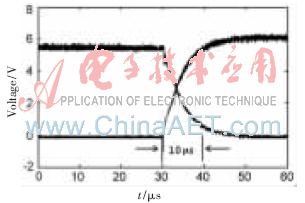
圖8 高壓脈沖的上升、下降沿測試圖
4.3 細胞分選的測試
用羅丹明液滴模擬帶有癌細胞的液滴進行細胞分選。當檢測到超過閾值的熒光脈沖時,系統經過一定時間后產生一個脈沖分選出對應的液滴。圖9是在顯微鏡下觀察到的一組結果。
從圖9中可以看到,在電極上加上600 V、50 ms脈寬的高壓脈沖后,待分選的液滴發生偏離,而其余的液滴不受影響,最后成功將待分選液滴分選到左側的溝道當中。

圖9 高壓脈沖分選細胞測試圖
設計的基于微流控芯片的流式細胞分選系統采用AVR單片機為核心處理器,完成了微弱細胞熒光的檢測電路的設計、細胞分選高壓脈沖電路以及控制電路設計,在單片微流控芯片上實現了癌細胞的檢測、計數以及分選。系統的硬件部分已經初步完成,經過測試,硬件各方面的參數均能滿足系統的要求,為后期系統的整合和優化打下了比較好的基礎。
參考文獻
[1] 葉曉蘭, 杜文斌, 古淑青,等. 基于正交光路系統的小型流式細胞儀的研究[C]. 中國化學學會第十四屆有機分析及生物分析學術研討會會議論文摘要集, 2007.
[2] 高健, 殷學鋒, 方肇倫. 微流控芯片系統在單細胞研究中的應用[J]. 化學進展,2004,16(6):975-983.
[3] HOLMES D, MORGAN H, GREEN N G. High throughput particle analysis: Combining dielectrophoretic particle focussing with confocal optical detection. Biosensors and Bioelectronics, 2006,21(8):1621-1630.
[4] YANG S Y, HSIUNG S K, HUNG Y C, et al. A cell couing/sorting system incorporated with a microfabricated flow cytometer chip. Measurement Science and Technology, 2006,17(7):2001-2009.
[5] 郭從良, 孫金軍, 方容川,等. 光電倍增管的噪聲分析和建模[J]. 光學技術, 2003,29(5):636-640.
[6] 何瑾, 劉鐵根, 孟卓,等. 弱光強信號檢測系統前級放大電路的設計[J]. 科學技術與工程,2007,7(9):1904-1906.
[7] 李雙喜. 熒光微弱信號檢測電路設計[J]. 電子工程師, 2005,31(2):52-54.
[8] 楊茂, 胡立群, 毆艷敏,等.微弱光電流信號放大器的設計[J].核電子學與探測技術, 2011,31(7):734-738.
[9] 賽爾吉歐·佛朗哥. 基于運算放大器和模擬集成電路的電路設計[M]. 第3版. 劉樹棠,朱茂林,榮玫,譯.西安:西安交通大學出版社, 2009:297-298.
[10] 王松雁, 武洪臣, 王小峰,等. 絕緣柵雙極晶體管固體開關技術研究[J]. 強激光與粒子束, 2002,14(6):954-956.

